Zurück
Reaktionsrate
und Molekulargeschwindigkeit
Wird die Temperatur eines reagierenden Gemisches erhöht, verdoppelt bis verdreifacht sich die Reaktionsgeschwindigkeit. Das ist der Inhalt einer – sehr groben – Regel. Auf welchem Hintergrund beruht diese Aussage?
by Gian Vasta
Chemische Reaktionen
Damit zwei Teilchen miteinander reagieren, müssen sie zusammenstossen. Bei einer Reaktion werden Bindungen gebrochen und neue gebildet. Damit Bindungen gebrochen werden können, muss die Energie des Zusammenstosses ein vom Reaktionstyp abhängige Grenze überschreiten.
Geschwindigkeitsverteilung
Die Moleküle eines Gases haben unterschiedliche Geschwindigkeiten. Stossen zwei langsame Moleküle zusammen, reicht die Energie unter Umständen nicht für eine Reaktion aus. Nur Teilchen mit genügender Energie können überhaupt reagieren, falls sie zusammenstossen. Wieviele sind das bei einem Gas von gegebener Temperatur? die Geschwindigkeitsverteilung gibt die Antwort auf diese Frage.
Das grundlegende Konzept lässt sich am einfachsten anhand von Diagrammen erläutern. Deshalb werden zunächst die speziellen Typen von Diagrammen eingeführt, die für Verteilungen benutzt werden.
Gleichverteilung
Die einfachste denkbare Verteilung von Molekülgeschwindigkeiten ist die Gleichverteilung. Wir stellen und ein hypothetisches Gas vor in einem isolierten Gefäss; wie in einem realen Gas hat jedes Molekül unseres Phantasiegases eine andere Geschwindigkeit. Im Gegensatz zu realen Gasen gibt es aber für jeden Bereich von Geschwindigkeiten gleich viele Moleküle.
Diese Geschwindigkeitsverteilung ist in nachstehendem Diagramm dargestellt. Die Einheit der Ordinatenachse ist so gewählt, dass die Fläche unter der Kurve der Anzahl Moleküle entspricht, deren Geschwindigkeit in einem bestimmten Bereich (Im Beispiel zwischen 120 und 315 m/s) liegt.
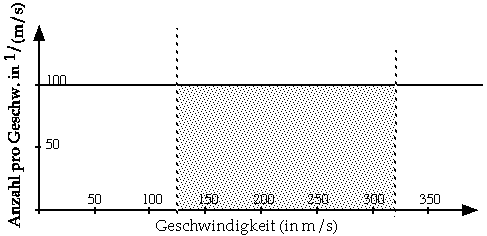
Aufgabe
- Wieviele Teilchen haben Geschwindigkeiten zwischen 300 und 200 m/s? Zwischen 300 und 100 m/s? Zwischen 300 und 0 m/s?
- Zeichnen Sie mit Ihren Zahlen ein Diagramm Reaktionsrate gegen Teilchengeschwindigkeit. Nehmen Sie an, es würden nur Teilchen mit Geschwindigkeiten zwischen 200 und 300 m/s, bzw. zwischen 100 und 300m/s bzw. zwischen 0 und 100 m/s reagieren.
Ergebnis
Wenn die Molekülgeschwindigkeiten gleich verteilt wären, würden die Reaktionsraten linear mit der Breite des Geschwindigkeitsbereiches steigen.In reale Molekülanhäufungen sind die Geschwindigkeiten der Moleküle nicht gleich verteilt. Sehen wir uns deshalb eine etwas realistischere Geschwindigkeitsverteilung an.
Dreiecksverteilung
Ein wenig realistischer ist eine dreiecksförmige Geschwindigkeitsverteilung der Molekülgeschwindigkeiten, wie in folgendem Diagramm dargestellt.
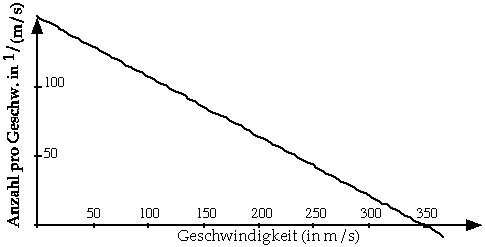
Aufgabe
Bestimmen Sie auch hier, wieviele Teilchen Geschwindigkeiten zwischen 250 und 350 m/s, zwischen 150 und 250 m/s und zwischen 50 und 150 m/s! Zeichnen Sie danach, wie oben, ein Diagramm Reaktionsrate gegen Geschwindigkeit, indem Sie annehmen, dass nur Moleküle mit Geschwindigkeiten über 50 m/s, über 150 m/s bzw. über 250 m/s reagieren können!
Ergebnis
Nun nimmt die Reaktionsrate quadratisch mit der Molekülgeschwindigkeit zu. Das ist zwar schon wesentlich besser als linear, entspricht aber noch immer nicht der Verdoppelung bei gleichmässigem Anstieg der Geschwindigkeit.Ohne weiter ins Detail zu gehen, sei hier einfach festgestellt, dass die Kurve der Geschwindigkeitsverteilung gegen Geschwindigkeit stärker als linear zunehmen muss, damit die Reaktionsrate wie beobachtet zunimmt. Die gesuchte Kurve ist also nach oben gebogen:
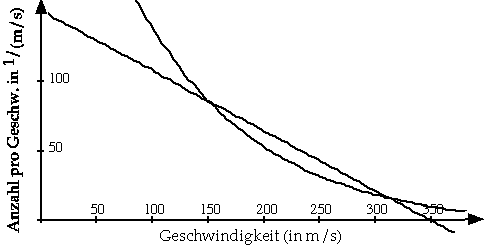
Die Fläche unter der gebogenen Kurve bleibt zwar zunächst hinter derjenigen unter der Geraden zurück, aber mit wachsendem Geschwindigkeitsbereich nimmt sie schneller zu.
Die Wirklichkeit
Wie sieht die Wirklichkeit aus? Nachstehende Skizze zeigt die Geschwindigkeitsverteilung für ein Gas in einem isolierten Gefäss bei drei unterschiedlichen Temperaturen. Es fällt auf, dass
- es bei hohen Temperaturen immer noch langsame Moleküle gibt, wenn auch weniger als bei tiefer Temperatur
- dass es bei tiefer Temperatur auch schnelle Moleküle gibt, wenn auch weniger zahlreich als bei hoher Temperatur
- dass der linke Teil der Kurven den vorausgesagten Verlauf zeigt (nach oben gebogen)
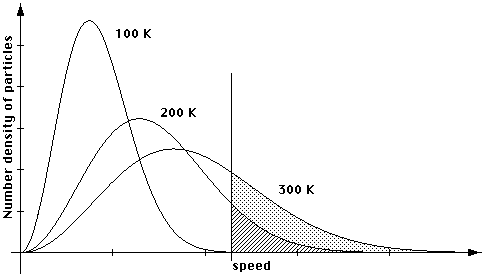
Die Anzahl der Moleküle ist wie bisher durch die Fläche unter der Kurve bestimmt. Können Sie erklären, warum die Höhe des Maximums mit zunehmender Temperatur abnehmen muss?
Aktivierungenergie
Damit zwei Moleküle reagieren können, müssen sie einerseits zusammenstossen. Andererseits muss der Zusammenstoss heftig genug sein, um Bindungen zu brechen; erst, wenn "alte" Bindungen gebrochen wurden, können sich neue bilden. Man spricht von Aktivierungsenergie. Das ist die Energie, die Moleküle benötigen, um reagieren zu können.
Im Diagramm sind die Moleküle eingetragen, die eine Geschwindigkeit grösser als eine Minimalgeschwindigkeit haben. Je schneller ein Molekül, desto mehr kinetische Energie hat es.
Es ist deutlich zu erkennen, dass die Anzahl der Moleküle, deren kinetische Energie einen minimalen Wert überschreitet, mit zunehmender Temperatur zunimmt. Bei 100 K hat praktisch kein Molekül die erforderliche Energie, bei 200 K ist es die der schraffierten Fläche entsprechende Anzahl, und bei 300 K ist es die der schraffierten plus der gepunkteten Fläche entsprechende Zahl. (Diese minimale Energie ist nicht direkt die Aktivierungsenergie, hängt aber mit ihr zusammen).
Zurück
This page updated Wednesday, February 15, 2017 GVa
© Copyright 1999, 2017 Gian Vasta
No part of these documents, particularly the images, may be used for whatever purpose without the written consent of its author.
Alle Teile dieses Dokuments, insbesondere die Bilder, unterliegen dem Copyright und dürfen ohne schriftliche Einwilligung des jeweiligen Autors nicht verwendet, auch nicht in Teilen, oder verändert werden.
Gestaltung dieser Website: